La Border Disease : quels moyens de maîtrise et de prévention ?
Mercredi 4 Mai 2022 Rurale 43995© Gilles Meyer
Gilles Meyer et Fabien Corbière
Les auteurs de cet article déclarent ne pas avoir de confl it d'intérêt avec le sujet traité.
La Border Disease (BD) ou Maladie de la Frontière ou pestivirose ovine a été décrite pour la première fois en 1958/1959 à la frontière entre l'Angleterre et le Pays de Galles où elle sévissait de manière endémique. Elle est due au virus BDV, pestivirus proche du virus de la diarrhée virale bovine (BVDV). Moins connue et moins étudiée que la diarrhée virale bovine, elle n'en reste pas moins une affection majeure dans certaines régions françaises de production ovine.
Les contraintes liées aux élevages ovins, les spécificités liées au BDV et à l'espèce ovine font que des méthodes originales de contrôle collectif de cette maladie ont vu le jour assez rapidement, principalement dans le bassin de production de Roquefort.
Toutefois, que ce soit au niveau de l'élevage ou d'un système de production, de nombreuses interrogations demeurent sur les moyens pour lutter contre cette maladie et leur efficacité sur le terrain, comme par exemple l'intérêt de la vaccination hétérologue avec des vaccins BVDV.
Cet article fait une synthèse rapide des données sur la prévalence et l'importance de cette maladie et s'intéresse plus particulièrement aux moyens de gestion disponibles actuellement.
RÉPARTITION GÉOGRAPHIQUE ET IMPORTANCE ÉCONOMIQUE
La répartition géographique de la BD est mondiale. Elle a été notifiée dans différents pays d'Europe, aux Etats-Unis, en Australie, en Nouvelle-Zélande et au Japon, avec des prévalences d'élevages variant de 5 à 50 % d'un pays à l'autre mais aussi d'une région à l'autre à l'intérieur d'un même pays 1.
En France, la maladie a été identifiée pour la première fois en 1983-1984 dans le bassin de Roquefort entraînant des troubles sévères chez les agneaux mais aussi les adultes. Les élevages touchés enregistraient respectivement des taux de morbidité et de mortalité de 25 % et 7 % chez les adultes et des taux de mortalité chez les agneaux de 15 à 90 %. Cette forme particulièrement grave, dénommée « petega ovina » ou « aveyronite » incita l'instauration d'un suivi sérologique en Aveyron, réalisé dans un premier temps sur la base du dépistage d'anticorps sanguins à partir d'un échantillon d'animaux. A partir des années 1990, le nombre de cheptels séropositifs en BD a progressivement diminué dans cette région passant de 20 % en 1998, à une prévalence de 4 % en 2005. Entre 2008 et 2012, une recrudescence de l'incidence a été observée dans le bassin aveyronnais, la proportion d'élevages séropositifs étant remontée à 9,3 %, avec une différence significative entre cheptels laitiers (6 % de séropositifs) et allaitants (22 % de séropositifs) 2.
Les données sérologiques disponibles pour le reste de la France sont rares. Dans les Pyrénées-Atlantiques en 2014, la séroprévalence a été estimée respectivement à 14,9 % et 14,5 % dans les élevages laitiers (n = 980) et allaitants (n = 255) 3. La transhumance était considérée comme un facteur de risque majeur, entre 16 % et 20 % des troupeaux transhumants étant infectés contre 4 % - 10 % chez les non transhumants. En Ariège, en 2011/2012, une enquête sérologique, réalisée dans 92 % des cheptels transhumants et 69 % des estives, sur les primipares, les agnelles et les béliers a montré des taux de prévalence sérologique entre 20,7 % et 47,7 % 3. Toujours en Ariège, en 2013, des prélèvements virologiques sur agnelles dans les élevages identifiés fortement séropositifs ont montré une forte transmission hivernale intra-élevage du BDV, probablement liée à la présence d'animaux infectés permanents immunotolérants (IPI). A l'inverse, un sondage sérologique réalisé en 2017-2018 en Haute Vienne n'a pas permis d'identifier d'infection des troupeaux par le BDV (donnés de la Coopérative Départementale Agricole d'Action Sanitaire de la Haute Vienne).
A l'image des données de prévalence, les conséquences économiques d'une infection par le BDV dans un élevage ovin sont peu documentées.
Il est en effet compliqué d'obtenir des données précises, compte tenu des nombreux biais méthodologiques tels que l'absence d'enregistrement des traitements et des mortalités (surtout des agneaux), l'absence fréquente des déclarations d'avortement, la surveillance relative des brebis en estive...
Les conséquences de l'infection peuvent être multiples (cf. fig. 1). La maladie peut passer inaperçue et les pertes économiques liées aux infections transitoires peuvent être faibles. Cependant, dans certains cas, on observe des troubles de la reproduction (infertilité, avortements, mortinatalité) ainsi que, chez l'agneau, un fort affaiblissement, amaigrissement, de l'hyperthermie et l'apparition de maladies intercurrentes comme les diarrhées, les bronchopneumonies, l'ecthyma. Certains agneaux IPI présentent aussi des retards de croissance importants, des anomalies de la toison (poil hirsute ou animaux dépilés) ou bien des anomalies nerveuses (agneaux trembleurs), voire, plus rarement, des malformations osseuses et oculaires. Très rarement (cas de l'épizootie des années 1980 en Aveyron), des signes cliniques sévères peuvent être observés chez les adultes.
L'impact économique est surtout objectivé chez les agneaux, notamment dans les systèmes d'engraissement tels que ceux du bassin de Roquefort. L'épizootie de 2008 en Aveyron a entraîné de la morbidité et de la mortalité importantes chez les agneaux, d'abord dans les centres d'engraissement (30-50 % de mortalité et jusqu'à 100 % de morbidité) puis, dès 2009, dans les élevages naisseurs. Concernant l'impact sur la reproduction, une étude pilote 4, initiée en octobre 2013 dans le Sud-Ouest, a montré que les causes infectieuses d'avortement les plus fréquentes chez les ovins étaient la chlamydiose, la toxoplasmose et dans une moindre mesure la fièvre Q. Pour la BD, la circulation d'un pestivirus était rapportée dans 7,7 % des troupeaux (séropositivité des sentinelles). Dans les Pyrénées, l'impact du BDV sur la reproduction des troupeaux ovins est suspecté mais il n'existe pas de données exhaustives pour le confirmer. En revanche, il a été clairement montré la pathogénicité du BDV chez l'isard et ses conséquences (mortalités, troubles de la reproduction) sur la dynamique des populations dans cette espèce 5.
LA VARIABILITÉ GÉNÉTIQUE DES PESTIVIRUS : CONSÉQUENCES SUR LES MESURES DE GESTION
Forte diversité génétique
Le genre pestivirus comprenait à l'origine quatre espèces majeures : le virus de la peste porcine classique (CSFV), les BVDV de type 1 (BVDV-1) et de type 2 (BVDV-2) et le BDV. Depuis, d'autres pestivirus ont été isolés dans plusieurs espèces animales. La dernière classification officielle repose principalement sur les analyses comparatives des génomes et définit onze espèces de pestivirus (cf. fig. 2). Ce sont tous des virus enveloppés sphériques d'environ 40-60 nm de diamètre dont le génome est constitué d'une molécule d'ARN simple brin. La présence d'un génome à ARN explique l'importante variabilité génétique des pestivirus (par mutations et recombinaisons) avec des fréquences de mutation comprises entre 10-3 et 10-4 substitutions par nucléotides.
Cette forte variabilité génétique est à la base de la définition de sous génotypes viraux, huit sous-génotypes viraux étant actuellement définis pour le BDV (cf. fig. 2) contre vingt et un pour le BVDV-1 et quatre pour le BVDV-2 6,7.
En France entre 1985 et 2006, il a été montré la circulation de souches de BDV-3, BDV-4, BDV-5 et BDV-6 6. Le BDV-5 comprend notamment la souche Aveyronite (AV) isolée pour la première fois en 1984 et responsable de la Petega ovina. Les sous-génotypes BDV-3 et BDV-6 sont les plus fréquemment identifiés dans le Centre de la France (bassin de Roquefort), alors que les isolats pyrénéens appartiennent au BDV-4. Lors de l'épizootie de 2008, il a été suggéré que dans chaque foyer, les séquences des isolats étaient identiques (entre 99,4 et 100 % d'identité) 8. En revanche, entre deux foyers, même proches de moins de dix kilomètres, les isolats montraient des séquences divergentes entre 74,2 et 86,2 % d'identité 8.
Important pouvoir d'adaptation
La diversité génétique des pestivirus se traduit par une forte diversité antigénique et finalement phénotypique qui leur confère un important pouvoir d'adaptation.
- Elle pose en tout premier lieu la question de l'immunité croisée entre pestivirus d'un même génotype, voire de deux génotypes différents. L'utilisation d'anticorps monoclonaux a notamment montré qu'il existait une réaction antigénique croisée partielle plus ou moins importante entre BVDV-1, BVDV-2 et BDV. De manière générale, la diversité antigénique est considérée comme significative et importante entre BVDV-1 et BVDV-2 et, à fortiori, entre le BVDV et BDV (voir infra, vaccination). Elle peut être conséquente entre les différents sous-génotypes d'un même génotype 9, mais très peu à l'intérieur d'un même sous-génotype. Concernant l'immunité induite par les vaccins, les données de la littérature montrent des résultats divergents en termes de protection croisée entre génotypes de BVDV, en fonction des types de vaccin testés, des souches vaccinales et des protocoles d'étude utilisés. La protection hétérologue entre génotypes serait plus large avec des souches vaccinales de BVDV-1 qu'avec des souches BVDV-2. La protection croisée pourrait également être variable entre les différents sous-groupes du BVDV-1 même si elle est plus efficace qu'entre les différentes espèces puisqu'elle permet la protection contre les infections in vivo 10. Lors d'inoculations d'épreuve, la protection vaccinale homologue (souche d'épreuve = souche vaccinale) reste toujours supérieure à la protection hétérologue.
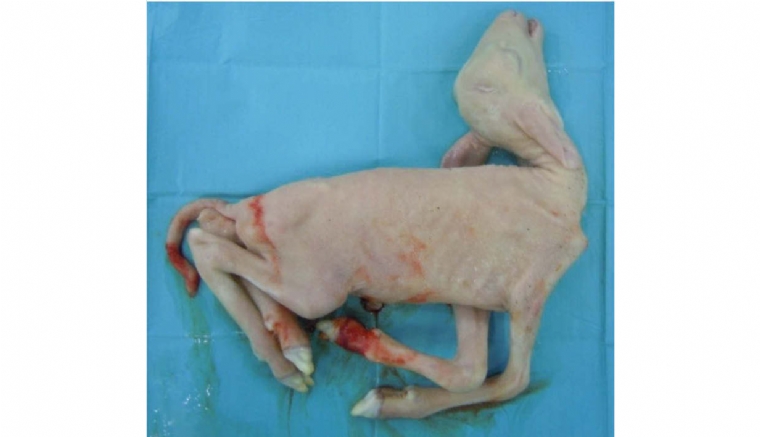
- L'impact sur le pouvoir pathogène du BDV n'est en fait pas très connu, en raison du faible nombre d'études associant des résultats d'impact clinique et économique à l'isolement et au génotypage des souches. Si on considère, comme pour le BVDV, que des souches sont plus pathogènes que d'autres, il est actuellement impossible d'affirmer qu'un sous-génotype est plus pathogène qu'un autre. La souche Aveyronite de BDV-5 isolée en Aveyron en 1983-1984 était responsable d'un fort pourcentage de mortalité non seulement chez les agneaux mais aussi les adultes sans que l'on sache si cela était dû à un effet souche ou à l'arrivée d'un nouveau virus sur une population naïve. Plus récemment, en 2014, une épizootie sévère à pestivirus avec un fort taux de mortalité chez les agneaux a été notifiée en Espagne. Tous les isolats présentaient un degré d'homologie élevé sur la séquence 5'UTR avec la souche Aveyronite isolée en France en 1984 11. Dans le bassin de Roquefort, lors de l'épizootie sévère de 2008, les seuls isolats séquencés appartenaient aux BDV-3 et BDV-6 et non pas au BDV-5 8. Une étude expérimentale menée à l'ENVT a évalué la pathogénicité de quatre souches BDV de génotypes différents chez des brebis gestantes (BDV-5, BDV-4, BDV-6 et BDV-3) 12. Toutes les souches ont infecté tous les foetus de brebis inoculées à 52 jours de gestation. Toutefois, la souche BDV-5 était principalement responsable d'avortements, la souche BDV-4 induisait majoritairement des malformations foetales type arthrogrypose, hydroencéphalie (cf. photos 1, 2, 3, 4 de l'encadré 1) et pour les souches BDV-3 et BDV-6, tous les foetus étaient viropositifs mais d'apparence normale. Là encore, on ne peut pas certifier qu'il s'agisse d'un effet sous-génotype, une seule souche par génotype ayant été testée.
- L'impact sur le passage de la barrière d'espèce est lui mieux renseigné. Le virus BVDV infecte les bovins et les ovins (et dans une moindre mesure les caprins). Notamment l'infection expérimentale de brebis à 52 jours de gestation avec une souche BVDV non cytopathogène (ncp) aboutit à l'infection du foetus et la production d'agneaux IPI, tout comme une souche BDV ncp 12.
Sur le terrain, l'infection de petits ruminants par le BVDV lors de transhumance avec des bovins infectés a été clairement démontrée en Autriche et la question du réservoir épidémiologique dans cette espèce clairement posée 13. En France, il n'existe pas de données exhaustives sur l'importance de l'infection des ovins par le BVDV. Sur les rares prélèvements de pestivirus réalisés chaque année, c'est le BDV qui est identifié dans la très grande majorité des cas.
Le BDV a, quant à lui, aussi été isolé chez les bovins, les chèvres et les porcins mais on ne connaît pas la fréquence réelle de ces infections croisées.
Plusieurs études suggèrent cependant de considérer le BDV dans les phases finales des plans de contrôle de la BVD. En Suisse, pays indemne de BVD, il a été montré que des brebis infectées par le BDV, montées à l'estive avec des bovins étaient capables de transmettre le virus à ces derniers, qui par la suite se séropositivent en anticorps NS2-3 14. Expérimentalement, un veau IPI en BDV est capable de contaminer des génisses en début de gestation et le virus infecte alors de manière persistante leur foetus 15.
Outre les ruminants domestiques, les pestivirus sont aussi connus pour infecter les ruminants sauvages. Certains petits ruminants sauvages comme les chamois et probablement les bouquetins, sont réceptifs au BDV. La première épidémie importante de BDV-4 chez les isards pyrénéens a été décrite en 2000-2001 dans la réserve catalane d'Alt Pallars-Aran et continue à sévir sur une grande partie du massif pyrénéen.
Les souches de BDV-4 isolées sur les moutons pyrénéens et les isards sont très proches phylogénétiquement, suggérant à minima un ancêtre commun.
CONTRÔLE DE LA BORDER DISEASE
Le contrôle de la BD repose sur des mesures de prophylaxie sanitaire couplées, ou non, à la vaccination (cf. encadré 2). Il peut être organisé à l'échelle d'une filière de production ou à un niveau individuel. Si les principes sont, grosso modo, les mêmes que pour la gestion de la BVD, les caractéristiques des troupeaux ovins et de la filière ovine (lait notamment), les spécificités liées au virus BDV et à la réponse immunitaire des ovins ont permis de développer des stratégies régionales originales, notamment dans le bassin de Roquefort.
La prophylaxie sanitaire
La mise en oeuvre d'une prophylaxie sanitaire a pour principaux objectifs :
- à l'échelle d'un bassin de production, d'améliorer la biosécurité externe et la sécurisation des mouvements d'animaux, en identifiant les élevages dans lesquels une circulation virale est probable, et en attribuant un statut épidémiologique favorable avec un niveau de confiance variable pour les autres élevages ;
- dans les élevages dans lesquels une circulation du virus est mise en évidence, de détecter et d'éliminer les animaux IPI (cf. fig. 3), et ainsi favoriser une réduction voire un arrêt de la circulation virale.
La prophylaxie sanitaire repose principalement sur des mesures de biosécurité externe classiques non spécifiques (quarantaine, maitrise des contacts entre cheptels...) et la mise en oeuvre d'examens de laboratoire permettant de définir le statut sanitaire à l'échelle individuelle ou du troupeau vis-à-vis de la BD. Les mesures de biosécurité doivent prendre en compte la possibilité de contaminations interspécifiques, notamment entre bovins et ovins, que ce soit avec le BVDV ou BDV. Dans les Pyrénées Atlantiques, le risque de contamination des troupeaux mixtes ovin-bovin était ainsi plus important que pour les élevages ovins spécialisés (au moins avant la mise en place du plan National BVD, constat à réactualiser à la lumière des avancées du plan de gestion de la circulation virale chez les bovins).
- Modalités de dépistage de la BD à l'échelle collective
La définition du statut sanitaire des élevages s'inscrit dans une démarche collective de lutte, à l'instar de ce qui a prévalu à la mise en place du plan national BVD chez les bovins. Cette stratégie repose sur la mise en oeuvre régulière d'une recherche d'anticorps NS 2-3 permettant de suspecter une circulation du virus. Dans le bassin ovin laitier du Rayon de Roquefort une démarche structurée a été mise en place dès les années 1980 suite à l'épisode de « Pétéga ovina », en réalisant un suivi sérologique annuel des troupeaux sélectionneurs, laitiers et allaitants, fondée sur l'analyse de cinq puis sept mélanges de cinq sérums issus de la prophylaxie, en ciblant les classes d'âge les plus informatives. La recrudescence de la circulation virale en 2008/2009 a conduit à renforcer le dispositif en l'élargissant de manière plus régulière aux troupeaux hors schéma de sélection. Depuis l'hiver 2010/2011, suite à la validation des seuils d'interprétation d'un ELISA anticorps NS2-3 réalisé sur le lait de tank de brebis et à l'évaluation des performances de cette approche diagnostique 16, un dépistage complémentaire sur lait de tank a été mis en place dans les cheptels laitiers. Cette approche a aussi été mise en place dans les troupeaux ovins laitiers des Pyrénées Atlantiques. L'analyse sur lait de tank permet de définir un statut sanitaire plus précocement dans la campagne (dès le début de la traite des brebis, soit en majorité dès fin octobre début novembre en Rayon de Roquefort) comparativement à ce que permet la prophylaxie officielle (entre janvier et mars). La complémentarité des deux approches (lait de tank + sérums de prophylaxie en mélange) réside dans le fait que l'analyse sur lait de tank ne permet généralement pas d'inclure les primipares pour lesquelles les agnelages sont plus tardifs. En effet, contrairement à ce qui a été retenu chez les bovins, les analyses sur lait de tank sont rarement effectuées plusieurs fois durant la campagne laitière. Notons par ailleurs que d'après les estimations faites, une circulation récente ou induisant une prévalence sérologique inférieure à 10 %, ne peut être détectée par la recherche d'anticorps sur lait de tank, montrant aussi l'apport des analyses sur sérums.
Enfin, lors de résultat positif ou douteux sur lait de tank faisant suite à des résultats précédemment négatifs, suggérant donc une circulation virale, des analyses sérologiques complémentaires sont rapidement réalisées sur un échantillon de dix à vingt ovins « sentinelles » (généralement les antenaises) afin de confirmer ou d'infirmer une circulation virale.
Dans les troupeaux allaitants, anciennement positifs ou vaccinant avec un vaccin marqueur (Mucosiffa® et Bovela®, vaccins à virus vivant atténué induisant une séroconversion forte et durable) la définition du statut sanitaire repose uniquement sur l'analyse sérologique d'un échantillon d'ovins sentinelles (généralement 10 à 15 agnelles de six mois avant la vaccination et la mise à la reproduction, ou antenaises lors de la prophylaxie en élevage allaitant, avec analyse sérologique de mélanges de cinq échantillons).
Dans les bassins où les contacts ou mélanges de troupeaux sont fréquents ou induits par l'estive, la stratégie de prophylaxie sanitaire collective permet par ailleurs de s'assurer du statut sanitaire favorable des troupeaux en contact. Des mesures restrictives aux mélanges d'animaux issus de troupeaux de statuts sanitaires différents bénéficieraient à être généralisées dans le cadre d'une lutte collective. Par ailleurs, pour les élevages transhumants, la définition d'un statut sanitaire dès la descente d'estive serait aussi bénéfique, permettant la détection précoce des troupeaux nouvellement contaminés. Ces mesures se heurtent cependant à des difficultés de faisabilité et d'acceptabilité.
- Dépistage des IPI en troupeaux infectés
Dans les troupeaux infectés, la détection et l'élimination des animaux IPI est, théoriquement, la mesure la plus importante, elle vise à réduire la circulation virale en en supprimant la principale source. Elle repose sur la recherche du pestivirus par qPCR sur des petits mélanges de cinq à dix échantillons, avec analyse individuelle en cas de résultat positif (cf. fig. 3). Une deuxième recherche virologique sur les individus positifs réalisée trois à quatre semaines plus tard, permettant d'établir leur statut IPI ou infecté transitoire est conseillée, mais peut être décidée au cas par cas, selon la proportion initiale de résultats positifs. En particulier, si le nombre d'animaux viropositifs est faible, il est généralement conseillé de les réformer dans les plus brefs délais. Les animaux ciblés sont en priorité des agnelles de renouvellement voire les primipares et les jeunes béliers.
Dans certains cas cependant, mais heureusement très minoritaires, des animaux IPI plus âgés peuvent exister, ce qui suggère qu'une recherche sur l'ensemble du troupeau peut être nécessaire lors d'une persistance de la circulation virale (en dehors des cas où une re-contamination du troupeau en raison d'un défaut de biosécurité externe est mise en évidence).
Sur le terrain, compte tenu des coûts analytiques importants engendrés, la détection des IPI est rarement mise en oeuvre en première intention et ne peut s'envisager que lorsqu'une aide financière par les GDS et/ou groupements de producteurs est possible. Cette stratégie peut s'avérer complémentaire de la vaccination et est parfois indispensable dans les situations où la vaccination n'offre pas les résultats escomptés.
La vaccination
Théoriquement, il est attendu de la vaccination une protection clinique et virologique contre une infection transitoire mais surtout contre l'infection foetale pour prévenir la naissance d'agneaux IPI. Il n'existe actuellement pas de vaccin possédant une AMM pour la BD. Les seuls vaccins disponibles sur le marché et utilisés sur le terrain dans le cadre de la cascade sont des vaccins BVDV. Ces vaccins ne possèdent pas de souches de BDV dans leurs compositions. Ils sont le plus souvent utilisés avec la moitié, voire quelquefois le quart de la dose utilisée chez les bovins, pour des raisons économiques.
Qu'en est-il de la protection croisée induite par les vaccins BVD contre une infection à BDV chez les ovins ? Le recours à un vaccin destiné à une autre espèce pour un autre virus soulève plusieurs questions concernant la population cible à vacciner, la durée d'un plan vaccinal, la dose à utiliser et surtout l'efficacité démontrée des vaccins BVDV vis-à-vis des souches hétérologues de BDV.
Dans un premier temps, il a été montré que des brebis vaccinées à demi-dose avec deux vaccins BVD actuellement commercialisés produisaient des anticorps capables de neutraliser in vitro différentes souches de BDV 8. Toutefois, on observait une variabilité individuelle importante dans chaque groupe testé et la réponse neutralisante hétérologue (contre les souches de BDV) décroissait rapidement dès trois mois post-vaccination alors que la réponse homologue (contre une souche de BVDV) restait stable sur les six mois de l'étude. Cela suggère que, si la vaccination doit être utilisée, elle doit être pratiquée dans un délai court avant la mise à la reproduction, de manière à ce que le taux d'anticorps soit maximal chez les brebis pendant les 70 premiers jours de la gestation.
Plus récemment, l'ENVT et la FODSA (Fédération des Organismes de Défense Sanitaire de l'Aveyron) ont investi la question de la protection foetale vaccinale contre le BDV. Trois vaccins BVDV commercialisés (Bovilis BVD® (MSD), Mucosiffa® (CEVA), Bovela® (Boehringer)) et couramment utilisés à demi-dose sur le terrain ont été testés pour leur efficacité en protection foetale chez la brebis lors d'une inoculation d'épreuve avec un virus BDV-6 (cf. encadré 3 8). Les principaux résultats montrent, dans ce modèle d'épreuve sévère, que les trois vaccins induisent chez les brebis la production d'anticorps neutralisants le BVDV-1 et le BDV-6 mais qu'ils ne permettent pas de protéger les brebis contre une infection foetale par le BDV-6. On pourrait expliquer cet échec en supposant que le modèle d'inoculation à BDV-6 (avec une très forte charge virale par une injection IM), aurait permis la libération rapide de grandes quantités de virus dans le sang et ainsi dépasser les capacités de neutralisation des anticorps présents, quels que soient les taux observés chez les individus. D'autant que les titres hétérologues neutralisants le BDV-6 obtenus dans cette étude étaient effectivement inférieurs à ceux neutralisants le BVDV-1. Dans la littérature sur le BVDV, la réponse en anticorps neutralisants a été largement utilisée comme un paramètre important pour évaluer les réponses immunitaires post vaccinales ou post infectieuses. La relation entre les titres en anticorps neutralisants et la protection, notamment foetale, reste toutefois discutée et la diversité des méthodes de séroneutralisation rend difficile les comparaisons entre études 18,19. Pour exemple, Beer et al. 20 ont montré qu'un seuil-titre minimal d'anticorps neutralisants de 1:512 était nécessaire pour une protection marquée contre l'infection par le BVDV chez les bovins. Toutefois avec des titres inferieurs chez les bovins, il a pu être montré dans une autre étude une protection de 100 % des foetus chez des bovins vaccinés avec Mucosiffa 21.
Il n'existe malheureusement pas d'études épidémiologiques exhaustives sur l'efficacité de la vaccination BVD contre la BD. Tout au plus, un document scientifique soulignait l'effet positif d'un programme de vaccination (vaccin inactivé Bovilis BVD®, MSD) sur un troupeau de 1400 ovins Lacaune quand il est combiné à un programme de dépistage/élimination des IPI et à l'absence d'introduction d'animaux d'origine extérieure 22. La part liée à la vaccination n'a cependant pas été objectivée/quantifiée.
Sur le terrain, les avis des vétérinaires et éleveurs indiquent une grande variabilité de situations quant à l'efficacité de la vaccination BVD contre la BD en partie liée aux modalités de la vaccination, aux statuts sanitaires des élevages (infections transitoires, présence d'IPI) mais aussi aux souches virales circulantes (pouvoir pathogène, distance génétique...) et à la variabilité individuelle importante de la réponse en anticorps neutralisants chez les ovins vaccinés. En considérant la notion de seuil relatif minimal d'anticorps neutralisants protecteurs, une brebis répondant mal à la vaccination et infectée à des doses élevées d'une souche virale très pathogène ne serait pas en mesure d'empêcher l'infection de son foetus. A l'extrême, une brebis bien immunisée et infectée par une souche faiblement pathogène et à faible dose le serait. Dans cette hypothèse, toutes les situations intermédiaires individuelles et finalement collectives seraient possibles. Il est en tout cas admis, sans démonstration scientifique toutefois, que dans certaines conditions, la vaccination apporte un gain réel au contrôle de la BD, d'autant plus quand elle est couplée à des mesures de prophylaxie sanitaires et de biosécurité.
En l'état des connaissances scientifiques actuelles, la vaccination devrait principalement être envisagée comme mesure complémentaire à un programme de biosécurité et si possible de dépistage/élimination des IPI. Elle pourrait aussi être considérée dans des situations à risque pour augmenter l'immunité du troupeau, telles que la non maîtrise de l'infection dans un élevage, le risque pour le voisinage ou les élevages en lien épidémiologique, la mise en estive des animaux...
CONCLUSIONS
Le contrôle et la lutte contre la BD à l'échelle individuelle reposent théoriquement sur les mêmes principes que ceux de la lutte contre la BVD. Toutefois, elle doit tenir compte de nombreux facteurs liés à l'hôte et au virus BDV, aux contraintes techniques de la filière ovine (coût du dépistage, de la vaccination), à l'absence de vaccins homologues et à l'absence de politique de lutte nationale.
Au niveau collectif, si pour certaines régions probablement peu impactées par la BD, la lutte n'est pas prioritaire, d'autres régions ont mis en place des mesures de lutte originales reposant entre autres sur la biosécurité externe, la sécurisation des mouvements d'animaux, la détection et l'élimination des IPI, couplée ou non à la vaccination.
Concernant cette dernière, des recherches supplémentaires apparaissent nécessaires pour mieux comprendre l'infection foetale par le BDV et la protection foetale apportée par la vaccination, incluant la réponse neutralisante mais aussi les réponses immunitaires cellulaires innée et adaptative qui jouent un rôle essentiel.
Par ailleurs, les seuls résultats publiés sur l'efficacité des vaccins BVDV contre le BDV relancent l'intérêt de futurs vaccins BDV homologues.