De si mignonnes petites bêtes ! Les impacts des chats "domestiques" sur la biodiversité
Samedi 22 Juin 2024 Biodiversité-Faune sauvage 51238© Pascale Bradier-Girardeau
Hélène SOUBELET
Les animaux domestiques peuvent devenir envahissants et avoir des impacts négatifs sur la faune sauvage, en particulier les mammifères prédateurs lorsqu'ils ont accès au milieu extérieur et que leur nombre est important.
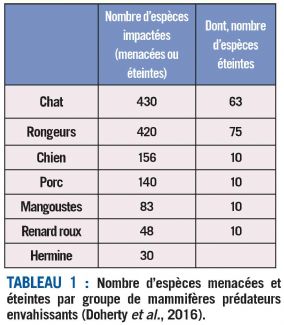
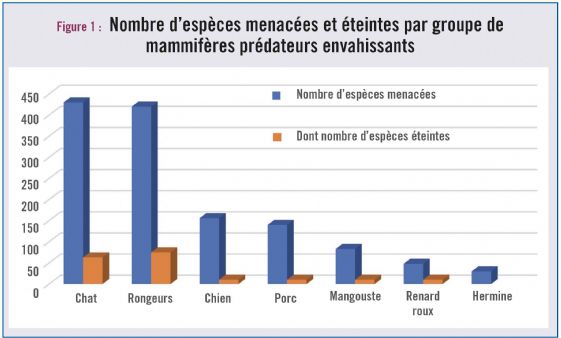
Trente espèces de prédateurs envahissants ont été identifiées comme responsables de l'extinction de près de 140 espèces et de la mise en danger de près de 600 espèces de vertébrés, soit 58 % de toutes les disparitions documentées d'oiseaux, de mammifères et de reptiles (Doherty et al, 2016).
Les groupes les plus impactants sont, dans l'ordre, les chats, les rongeurs, les chiens et les porcs (cf. tableau 1 et fig. 1).
Comprendre et atténuer l'impact des mammifères domestiques prédateurs est essentiel pour réduire le taux de perte de biodiversité mondiale.
Rats des villes et chats des champs
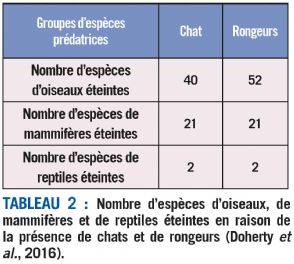
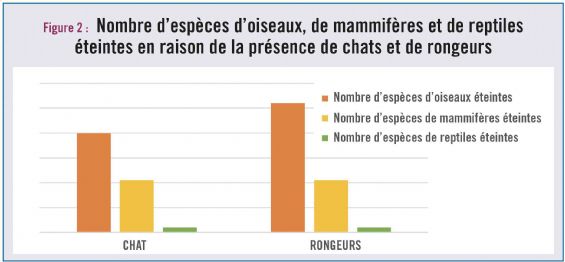
Les chats et les rongeurs sont, à eux-seuls, responsables de plus de 65 % des impacts documentés sur les oiseaux, les mammifères et les reptiles. Les chats auraient ainsi été déjà responsables de l'extinction de 63 espèces, en majorité des oiseaux, mais aussi de 21 espèces de mammifères et de deux espèces de reptiles. Quant aux rats, essentiellement le rat noir (Rattus rattus), le rat du Pacifique (R. exulans), le rat surmulot (R. norvegicus) et la souris domestique (Mus musculus), ils sont responsables de la disparition de 75 espèces, soit 52 espèces d'oiseaux, 21 espèces de mammifères et 2 espèces de reptiles (cf. tableau 2 et fig. 2).
Le chat domestique (Felis catus) est un prédateur qui, même bien nourri ou stérilisé, peut avoir des impacts sur ses proies naturelles. Par ailleurs, le succès d'empathie de cette espèce auprès des humains, a conduit à la présence de chats partout dans le monde et la multiplication de leurs effectifs. Les chats auraient ainsi déjà contribué à 26 % des extinctions de reptiles, d'oiseaux et de mammifères (Doherty et al. 2016) et représentent un risque mondial pour les vertébrés menacés et en voie de disparition.
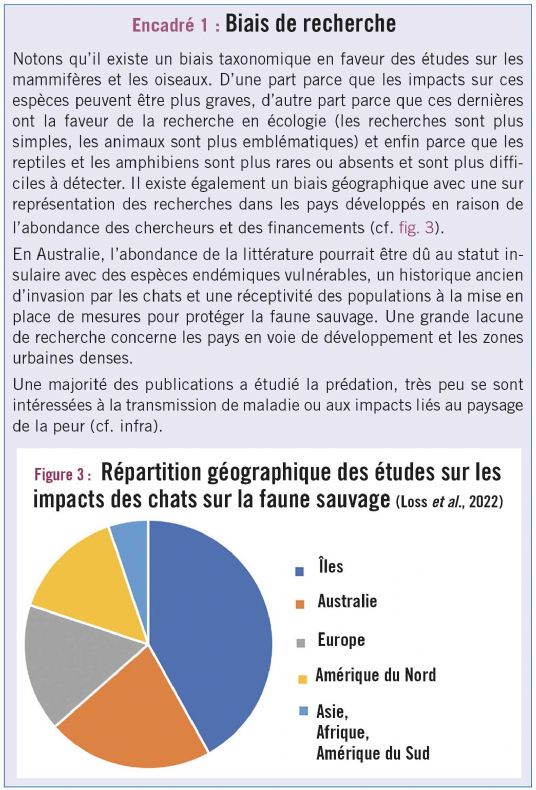
Pour compléter la connaissance sur le sujet, des chercheurs américains (Loss et al., 2022) ont réalisé une grande revue de la littérature scientifique mondiale pour mieux comprendre les impacts des chats domestiques sur la faune sauvage, analysant 332 publications publiées entre 1936 et 2021. Ces études concernent 37 pays dans tous les continents, sauf l'antarctique, et 74 îles dans tous les océans sauf l'arctique. La majorité des études ont documenté des effets négatifs des chats. Seules 11 % des études n'ont documenté aucun effet significatif et quelques études ont montré des effets positifs, en particulier sur les îles où ils peuvent diminuer la prédation sur les oiseaux, en régulant les rats ou d'autres prédateurs envahissants (Courchamp et al., 1999).
Prédation par les chats
Le chat est un prédateur assez généraliste. Il peut se nourrir de petits mammifères, d'amphibiens, de reptiles, d'oiseaux et d'invertébrés. L'exemple le plus ancien d'extinctions dues à l'introduction de chats est celui de l'île Macquarie où des chats introduits ont coexisté sur l'île pendant 60 ans avec la perruche endémique, Cyanoramphus novaezelandiae erythrotis, avant de devenir envahissants : après l'introduction des lapins, leur population a rapidement augmenté et les perruches ont disparu en 10 ans (Taylor, 1979). Les estimations, régulièrement révisées, des impacts montrent que la prédation par les chats est massive (cf. tableau 3).
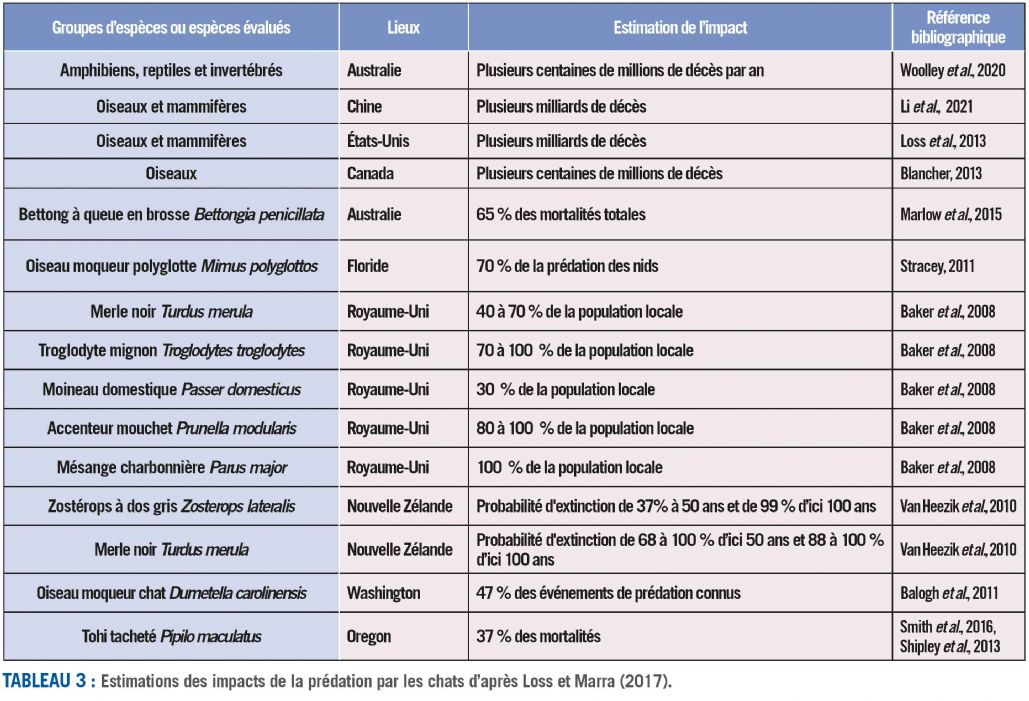
Transmission des maladies
- La toxoplasmose
Les chats sont porteurs de pathogènes (comme le virus de la rage ou l'agent de la toxoplasmose), transmissibles aux humains mais également aux animaux sauvages.
Cette question reste néanmoins une grande lacune de littérature scientifique, en particulier pour savoir si le chat est effectivement le responsable de la transmission à la faune sauvage. Il est par exemple possible d'utiliser le séquençage de l'ADN (ou ARN pour certains virus) pour identifier les souches pathogènes chez les chats domestiques et les comparer à celles présentes chez les espèces sauvages, ce qui est rarement fait.
Par exemple, une équipe américaine étudiant en post mortem, les causes du déclin des loutres de mer (Enhydra lutris nereis) en Californie, a démontré que les encéphalites à Toxoplasma gondii étaient responsables de 16,2 % des décès des loutres adultes, impact de même ampleur que ceux générés par les attaques de requins et les maladies cardiaques (Kreuder et al., 2003). Confirmée en 1992, la maladie est récente chez les loutres de mer et ces animaux ne sont immunologiquement pas préparés à la combattre. Elle provoque des malformations congénitales, des avortements et des encéphalites. Ces auteurs ont aussi démontré que la toxoplasmose aggravait le risque de décès cardiaque ou d'attaque mortelle de requin et donc le risque de déclin des populations de loutres. Ainsi, les loutres avec une encéphalite avaient 3,7 fois plus de chances d'être attaquées par les requins et celles diagnostiquées avec une maladie cardiaque étaient 2,9 fois plus susceptibles d'avoir simultanément une encéphalite à T. gondii que les loutres sans problème cardiaque. Il est probable que les loutres atteintes d'encéphalites aient plus de mal à se soustraire aux attaques des prédateurs, elles pourraient même les attirer en raison des mouvements anormaux et convulsions provoquées par la maladie. Ces conclusions sont cohérentes avec les constats d'augmentation de la proportion de loutres attaquées par les requins depuis 1968 et la corrélation avec le déclin de leur population. La prévalence de la toxoplasmose chez les loutres a été clairement reliée à l'expansion des populations de chats domestiques et d'opossums, la diminution des capacités de filtration naturelle des bassins versants et la perte de capacité d'absorption des sols, créant des ruissellements vers les estuaires.
Une équipe de recherche iranienne (Nayeri et al., 2021) a réalisé une synthèse de la littérature pour rechercher des éléments sur la prévalence de Toxoplasma dans les invertébrés marins, en particulier ceux consommés par les humains (moules, palourdes, coques...). La présence des oocystes de T. gondii est corrélée avec celle de diverses espèces de chats sauvages et domestiques. Dans l'environnement, l'oocyste peut rester infectieux sous forme sporulée dans le sol pendant au moins 18 mois et dans l'eau de mer pendant 6 mois. Les organismes filtreurs concentrent et retiennent les particules en suspension, y compris les oocystes de T. gondii qui sont captés par les branchies et les glandes digestives. Ces derniers peuvent survivre dans les organes de ces invertébrés et être transmis dans la chaîne alimentaire à l'hôte suivant, comme les poissons, les mammifères marins ou les humains. Des études expérimentales ont montré que les oocystes peuvent rester viables jusqu'à 85 jours dans les huîtres, pendant 3 jours dans les moules ou les poissons (Nayeri et al., 2021). D'autres voies de transmissions à explorer sont les biofilms à la surface des algues et des organismes benthiques ou la manipulation de poissons crus par les professionnels de la pêche ou de la transformation alimentaire.
- Protoparvovirose
Les chats domestiques sont identifiés comme réservoirs de protoparvovirus provoquant des épizooties et une mortalité chez les grands félidés en captivité (tigres, panthères etc.), constituant une menace pour leur conservation (Shetty et al., 2020). Les symptômes peuvent être une leucopénie, de la fièvre, une dépression, une déshydratation, une diarrhée et, plus rarement, une myocardite, une hypoplasie cérébelleuse et des difficultés de reproduction. En Inde, Une étude pilote a été menée dans la réserve indienne de biosphère des Nilgiri qui abrite la plus grande population de tigres du pays, des léopards, des chats léopards, des chaus, des chiens sauvages asiatiques, des ours lippus, des porcs-épics, des mangoustes, des civettes, des singes. Cette réserve est fréquentée par les humains, les chiens et les chats domestiques. L'étude a mis en évidence une proximité génétique entre les protoparvovirus des léopards et ceux des chats domestiques.
Ces résultats plaident en faveur de futures recherches sur les interactions entre animaux domestiques et sauvage au sein des pathosystèmes, incluant la caractérisation des hôtes réservoirs, des enquêtes écologiques et épidémiologiques et la mise en place d'un système de surveillance systématique et de long terme des maladies de la faune sauvage menacée et en voie de disparition.
Effet du paysage de la peur
De nombreuses espèces sauvages modifient leur comportement pour éviter la prédation. Malheureusement, il y a peu d'études sur la façon dont de tels changements de comportement affectent la reproduction ou la survie des espèces et peuvent aider à prédire les effets sur l'abondance des populations, voire les risques de déclin.
Nous savons néanmoins que la présence des chats entraine une baisse des interactions sociales chez les proies, une diminution de leurs déplacements, un changement d'utilisation de l'espace et des horaires d'activité, avec des effets sublétaux comme un stress physiologique ou une reproduction réduite qui peuvent, à terme, menacer les populations et les communautés d'animaux sauvages.
Deux chercheurs, espagnol et français (Balbontín & Møller, 2015), ont ainsi démontré que la sénescence reproductive (déclin du taux de reproduction avec l'âge) chez les hirondelles rustiques (Hirundo rustica) était plus rapide pour les individus exposés à de la prédation, mais uniquement dans les sites comptant de nombreux couples reproducteurs.
Au Brésil, Marina Duarte et Robert Young (2011) ont observé les interactions entre un groupe de ouistitis et une centaine de chats domestiques vivant sur 18 hectares dans le parc municipal de la ville de Belo Horizonte. Ils ont mis en évidence une prédation des ouistitis juvéniles par des chats domestiques avec une moyenne de 3,24 tentatives de prédation par jour. Ils ont également mis en évidence que parmi les 3 777 arbres de 275 espèces présents, les ouistitis ont choisi de coucher dans douze arbres seulement, à savoir des palmiers, des eucalyptus et des figuiers, caractérisés par une grande hauteur (en moyenne 22,5 mètres), avec des premières branches hautes (en moyenne à 10,36 mètres) et à l'écorce lisse ou épineuse. Les sites de couchage semblent avoir été choisis pour minimiser le risque de prédation par les chats. Par ailleurs, les ouistitis rejoignaient leur site de couchage uniquement depuis les arbres adjacents, augmentant leur effort et la dépense d'énergie au moment du coucher.
Au Royaume-Uni, une équipe de recherche (Bonnington et al., 2013) a travaillé sur les effets sublétaux de la présence des chats et des écureuils gris (exotiques envahissants) sur les nids de merles noirs (Turdus merula) urbains. Les résultats montrent que la présence des chats réduits le nombre de nourrissage par les parents sans augmentation compensatoire de la taille de la ration alimentaire apportée aux petits. Une étude antérieure montre que cette réduction de la quantité de nourriture apportée aux petits réduit leurs taux de croissance d'environ 40 %. Les écureuils gris induisent des effets similaires, mais plus faibles. La présence des prédateurs induit, dans ce cas, une obligation de défense parentale du nid qui demande de l'énergie et du temps aux parents.
Aux Etats-Unis, Kevin Crooks et Michael Soulé (1999) ont mis en évidence que la prédation par les chats domestiques et leur impact sur les populations d'oiseaux étaient aggravés par la disparition des coyotes, concurrents et prédateurs des chats. Les interactions trophiques se combinent aux effets de la fragmentation de paysages et contribuent à structurer, positivement ou négativement les communautés écologiques. Toujours aux Etats-Unis, Book & Freeberg, (2015) ont démontré que la mésange bicolore (Baeolophus bicolor) modifiait son comportement d'appel et de prise de graines en fonction du risque de prédation par les chats. Les mésanges ont montré des comportements d'évitement de la mangeoire lorsque des prédateurs félins leur faisaient face. Les cris des mésanges étaient également modifiés en fonction de l'orientation tête/corps du prédateur.
Conclusion
Les impacts des chats sur les populations de vertébrés restent le sujet de débats houleux. Des études quantitatives rigoureuses montrent clairement que les chats tuent un grand nombre de vertébrés, en particulier dans les îles, et peuvent avoir des effets sublétaux impactant les populations sauvages. Néanmoins, objectiver ces impacts sur la faune nécessite de bien séparer les impacts des chats des impacts des autres causes naturelles ou anthropiques sur la population de proies. Par ailleurs la connaissance sur les effets sublétaux des chats restent lacunaires.
Il faut aussi déterminer si les animaux seraient rapidement morts d'autres causes s'ils n'avaient pas été tués par des chats (mortalité compensatoire) ou s'ils ne seraient pas morts rapidement (mortalité additive). Une des particularités des prédateurs est qu'ils attaquent souvent des animaux en mauvaises conditions physiques, participant à la régulation des pathogènes dans les populations de proies (voir par exemple Baker et al., 2008). Les études de synthèse telle que celles de Loss et collaborateurs (2013, 2017) permettent de structurer les connaissances pour adapter au mieux les mesures de préservation des espèces sauvages. De nombreuses tentatives de gestion ont été testées et sont encore préconisées : le confinement des chats à l'intérieur des maisons ou des jardins grâce à des clôtures, l'élimination des chats des zones sensibles, l'équipement des animaux avec des clochettes ou des collerettes anti prédation, la stérilisation. La seule méthode toujours efficace est l'élimination des chats, les autres dispositifs ayant peu ou pas d'effet. Une étude a par ailleurs démontré que le nourrissage des chats pouvait augmenter la prédation (Maeda et al., 2019). Ces résultats montrent l'importance d'éduquer les propriétaires de chats aux impacts de leurs petits compagnons.
Références bibliographiques
Baker PJ, Molony S, Stone E, et al. 2008. Cats about town: is predation by free-ranging pet cats (Felis catus) likely to affect urban bird populations? Ibis 150: 86-99.
Balbontín, J., & Møller, A. P. (2015). Environmental conditions during early life accelerate the rate of senescence in a short-lived passerine bird. Ecology, 96, 948-959. https://doi.org/10.1890/14-1274.1
Balogh AL, Ryder TB, and Marra PP. 2011. Population demography of gray catbirds in the suburban matrix: sources, sinks, and domestic cats. J Ornithol 152: 717-26.
Blancher P.2013. Estimated number of birds killed by house cats (Felis catus) in Canada. Avian Conserv Ecol 8: 3.
Bonnington, C., Gaston, K. J., & Evans, K. L.(2013). Fearing the feline: Domestic cats reduce avian fecundity through trait-mediated indirect effects that increase nest predation by other species. Journal of Applied Ecology, 50, 15-24. https://doi.org/10.1111/1365-2664.12025
Book, D. L., & Freeberg, T. M. (2015). Titmouse calling and foraging are affected by head and body orientation of cat predator models and possible experience with real cats. Animal Cognition, 18, 1155-1164. https://doi.org/10.1007/s10071-015-0888-7
Courchamp, F., Langlais, M., & Sugihara, G. (1999). Cats protecting birds: Modelling the mesopredator release effect. Journal of Animal Ecology, 682, 282-292.
Crooks, K. R., & Soulé, M. E. (1999). Mesopredator release and avifaunal extinctions in a fragmented system. Nature, 400, 563-566. https://doi.org/10.1038/23028
Doherty, T. S., Glen, A. S., Nimmo, D. G., Ritchie, E. G., & Dickman, C. R. (2016). Invasive predators and global biodiversity loss. Proceedings of the National Academy of Sciences of the United States of America, 113, 11261-11265. https://doi.org/10.1073/pnas.1602480113
Duarte, M. H., & Young, R. J. (2011). Sleeping site selection by urban marmosets Callithrix penicillata under conditions of exceptionally high predator density. International Journal of Primatology, 322, 329-334. https://doi.org/10.1007/s10764-010-9468-5
Frank AS, Johnson CN, Potts JM, et al. 2014. Experimental evidence that feral cats cause local extirpation of small mammals in Australia's tropical savannas. J Appl Ecol 51: 1486-93.
Kreuder, C., Miller, M. A., Jessup, D. A., Lowenstine, L. J., Harris, M. D., Ames, J. A., ... & Mazet, J. A. K. (2003). Patterns of mortality in southern sea otters (Enhydra lutris nereis) from 1998-2001. Journal of Wildlife Diseases, 39(3), 495-509.
Li, Y., Wan, Y., Shen, H., Loss, S. R., Marra, P. P., & Li, Z. (2021). Estimates of wildlife killed by free-ranging cats in China. Biological Conservation, 253, 108929. https://doi.org/10.1016/j.biocon.2020.108929
Loss, S. R., Boughton, B., Cady, S. M., Londe, D. W., McKinney, C., O'Connell, T. J., ... & Robertson, E. P. (2022). Review and synthesis of the global literature on domestic cat impacts on wildlife. Journal of Animal Ecology, 91(7), 1361-1372.
Loss, S. R., & Marra, P. P. (2017). Population impacts of free-ranging domestic cats on mainland vertebrates. Frontiers in Ecology and the Environment, 15(9), 502-509.
Loss SR, Will T, and Marra PP. 2013. The impact of free-ranging domestic cats on wildlife of the United States. Nature Comm 4: 1396.
Maeda, T., Nakashita, R., Shionosaki, K., Yamada, F., & Watari, Y. (2019). Predation on endangered species by human-subsidized domestic cats on Tokunoshima Island. Scientific Reports, 9, 16200.
Marlow NJ, Thomas ND, Williams AA, et al. 2015. Cats (Felis catus) are more abundant and are the dominant predator of woylies (Bettongia penicillata) after sustained fox (Vulpes vulpes) control. Aust J Zool 63: 18-27.
Nayeri, T., Sarvi, S., & Daryani, A. (2021). Toxoplasma gondii in mollusks and cold-blooded animals: a systematic review. Parasitology, 148(8), 895-903.
Shetty, B. D., Zachariah, A., Farver, T. B., Smith, B., Goldstein, T., & Mazet, J. A. (2020). Carnivore protoparvovirus 1 (parvoviruses) at the domestic-wild carnivore interface in India. Journal of Zoo and Wildlife Medicine, 504, 1016-1020.
Shipley, A. A., Murphy, M. T., & Elzinga, A. H. (2013). Residential edges as ecological traps: Postfledging survival of a ground-nesting passerine in a forested urban park. The Auk, 130, 501-511. https://doi.org/10.1638/2018-0166
Smith SB, McKay JE, Richardson JK, et al.2016. Demography of a ground nesting bird in an urban system: are populations self-sustaining? Urban Ecosyst 19: 577-98.
Stracey CM. 2011. Resolving the urban nest predator paradox: the role of alternative foods for nest predators. Biol Conserv 144: 1545-52.
Taylor, H. R. How the Macquarie Island Parakeet became extinct. N. Z. J. Ecol. 2, 42-45 (1979).
Van Heezik Y, Smyth A, Adams A, et al. 2010. Do domestic cats impose an unsustainable harvest on urban bird populations? Biol Conserv 143: 121-30.
Woolley, L. A., Murphy, B. P., Geyle, H. M., Legge, S. M., Palmer, R. A., Dickman, C. R., & Woinarski, J. C. (2020). Introduced cats eating a continental fauna: Invertebrate consumption by feral cats Felis catus in Australia. Wildlife Research, 478, 610-623. https://doi.org/10.1071/WR19197








